

暨南大學(xué)范駿/戴勇團隊在Advanced Science發(fā)表POU3F3促進非小細胞肺癌進展的分子機制研究成果
暨南大學(xué)融媒體中心訊 近日,暨南大學(xué)基礎(chǔ)醫(yī)學(xué)與公共衛(wèi)生學(xué)院范駿、中醫(yī)學(xué)院戴勇和南京市第一醫(yī)院周丹陽團隊在中科院一區(qū)top期刊Advanced Science(IF=14.3)上發(fā)表了題為“Phosphorylation of POU3F3 Mediated Nuclear Translocation Promotes Proliferation in Non-Small Cell Lung Cancer through Accelerating ATP5PF Transcription and ATP Production”的研究成果,深入探討了非小細胞肺癌(NSCLC)中,八聚體結(jié)合蛋白3(POU3F3)異常高表達通過促進NSCLC細胞ATP生成,進而推動NSCLC進展的具體分子機制。

文章標(biāo)題頁截圖
腫瘤細胞即使在氧氣充足的情況下,也傾向于通過糖酵解途徑獲取能量,這一現(xiàn)象被稱為瓦博格效應(yīng)(Warburg effect)。然而,近年來的研究表明,氧化磷酸化(OXPHOS)仍然是腫瘤細胞獲取能量的重要途徑,并且靶向氧化磷酸化的策略在癌癥治療中顯示出顯著的臨床效果。八聚體結(jié)合蛋白家族成員在腫瘤的發(fā)生發(fā)展中起著關(guān)鍵作用,然而關(guān)于POU3F3在腫瘤中作用的研究相對較少。研究團隊發(fā)現(xiàn),POU3F3在NSCLC組織和細胞中顯著上調(diào),并促進了ATP的生成。機制上,上調(diào)的POU3F3進入細胞核,促進合成酶亞基ATP5PF的轉(zhuǎn)錄,增強了ATP合成酶各亞基之間的結(jié)合,從而促進了ATP合成酶的活性。
此外,研究團隊發(fā)現(xiàn)POU3F3是RAS-RAF-MEK-ERK信號通路的下游靶點。ERK1通過結(jié)合并磷酸化POU3F3的S393位點,促進了由importin β介導(dǎo)的POU3F3核轉(zhuǎn)位進程。進一步研究表明,突變型RAS抑制劑RMC-7977可以通過抑制RAS-RAF-MEK-ERK信號通路,從而抑制ERK的激活,減少POU3F3的核定位及其隨后的ATP合成酶活性。
本研究的主要科學(xué)貢獻包括首次揭示了POU3F3對NSCLC能量代謝的調(diào)控功能;發(fā)現(xiàn)POU3F3通過啟動ATP合成酶復(fù)合物亞基ATP5PF的轉(zhuǎn)錄,顯著增強了ATP合成酶的功能和ATP的生成;鑒定出POU3F3與ERK1的相互作用,明確了其磷酸化位點,并闡明了POU3F3核轉(zhuǎn)位的分子機制。上述結(jié)果不僅加深了對NSCLC發(fā)展分子機制的理解,還為藥物靶點的開發(fā)提供了堅實的理論基礎(chǔ)。
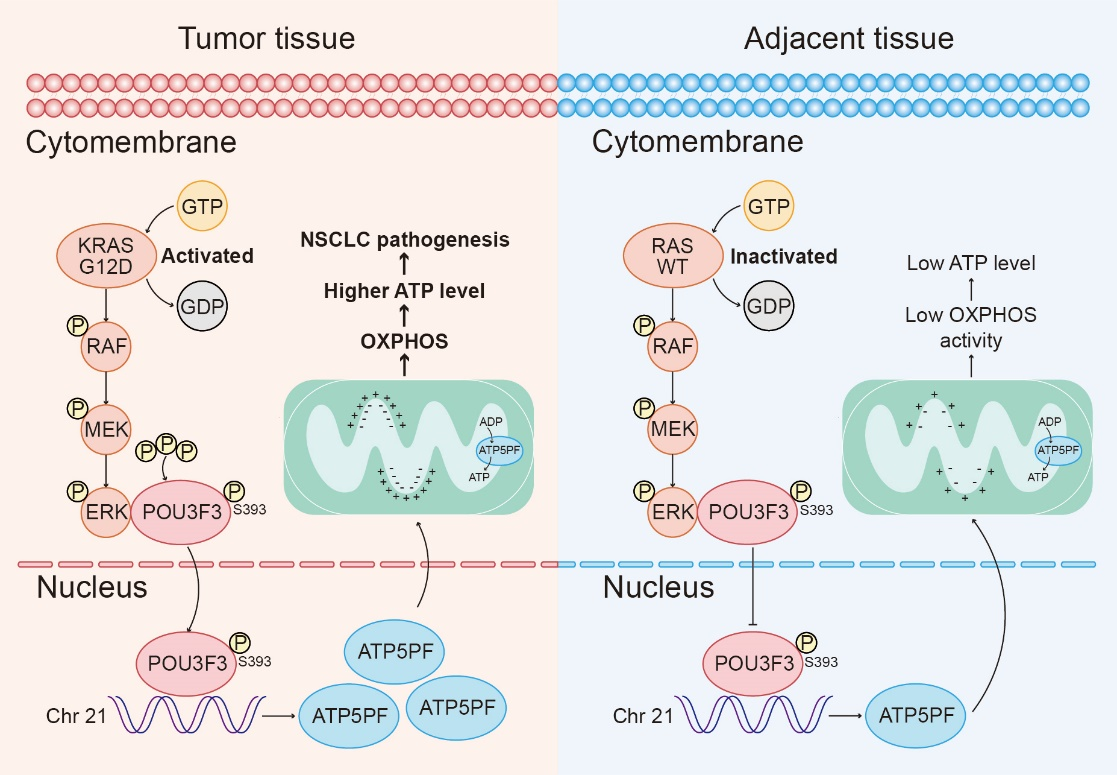
POU3F3通過促進OXPHOS和ATP的產(chǎn)生,進而促進NSCLC進展,并上調(diào)了ATP5PF的轉(zhuǎn)錄的機制示意圖
暨南大學(xué)李樂、曾琦岡、常桃、孫勇和鄭斌為本文的第一作者,暨南大學(xué)范駿、戴勇和南京市第一醫(yī)院周丹陽為本文的通訊作者。
全文鏈接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202411503
責(zé)編:蘇倩怡




